Medicamentos com fraudes é um grande problema enfrentado pela indústria de medicamentos , principalmente pela falta de rastreabilidade. Com a RDC 157 já é possível a regulamentação e a implementação do sistema nacional de controle de medicamentos, o que torna as práticas ilegais cada vez mais difíceis trazendo ao consumidor a segurança de estar utilizando produtos de qualidade. A norma coloca o Brasil em sintonia com o que já acontece em muitos outros países.
É Lei:
Depois de muito tempo em discussão foi promulgada em 2016,
sendo a rastreabilidade de medicamentos oficializada pelo governo brasileiro possibilitando que toda a cadeia produtiva se prepare para utilizar a tecnologia. Com o uso de etiqueta em cada produto a ser lida ou reescrita por terminais de checagem é possibilitado a identificação completa do caminho percorrido por aquele medicamento, desde a fabricação até o consumidor (rastreabilidade).
Enquanto não há a implantação dessas etiquetas para a rastreabilidade em todos os medicamentos alguns hospitais estão se adiantando e investindo em etiquetas, leitores, em automação e no sistema que irá gerenciar o estoque.
É possível investir de forma moderada, em fases e dentro dos orçamentos anuais de cada instituição para ir se adequando à nova lei.
Além da rastreabilidade o estabelecimento terá um estoque sempre organizado, com inventários menos frequentes e onde o desperdício é reduzido substancialmente, com estoque enxuto e programações de reposições sem emergências.
Empresas que serão impactadas
Essa regulamentação vai impactar empresas de diversos setores envolvidas em uma cadeia de medicamentos:
- fabricantes;
- distribuidores;
- laboratórios;
- hospitais; (privados e públicos)
- farmácias (tanto as grandes redes quanto os pequenos varejistas).
Para os pacientes, a vantagem principal está ligada à segurança. Com toda a rastreabilidade, a procedência dos medicamentos é garantida, evitando o comércio e consumo de itens não adequados ou com algum problema de fabricação; e para o fabricante e os estabelecimentos, a identificação de itens roubados e facilidade para recall são vantagens.
O setor de saúde busca auxiliar a indústria e órgãos de governo com soluções padronizadas para o controle e rastreabilidade de medicamentos. Neste momento, acompanha uma medida aplicada pela União Europeia (UE) – a Diretiva Medicamentos Falsificados –, que obriga o uso de dispositivos de verificação de ponta a ponta da cadeia para que os pacientes adquiram os remédios de forma segura.
As farmácias e os hospitais terão de verificar a autenticidade dos medicamentos antes de administrarem aos pacientes.
O novo sistema de verificação de ponta a ponta exige que as pessoas autorizadas verifiquem a autenticidade dos produtos ao longo de toda a cadeia de abastecimento. Assim, todos os envolvidos, diretamente e indiretamente, podem rastrear melhor os diferentes medicamentos, em especial se algum suscitar preocupações.
Métodos e sistemas
O novo sistema de automação (dispensários eletrônicos) dos medicamentos em dose unitária (produtos consignados por Identificação de radiofrequência) é um método de identificação automática através de sinais de rádio que recupera e armazena dados remotamente através de dispositivos denominados etiquetas RFID (do inglês "Radio-Frequency IDentification" ) permite a verificação de ponta a ponta, exige que as pessoas autorizadas (equipes “farmacêuticos, enfermagem e corpo clínico” nos hospitais) verifiquem a autenticidade dos produtos ao longo de toda a cadeia de abastecimento.
Assim, todos os responsáveis podem rastrear melhor os diferentes medicamentos, em especial se houver preocupação com algum deles.
Com a utilização de dispensários eletrônicos e processos de automação isso é possível porque, ao contrário do código de barras comum, que contém apenas o número de identificação do produto, o bidimensional também armazenará informações variáveis como lote, validade, número serial e o número de registro da Anvisa, o que permitirá todo o rastreamento e controle na cadeia logística. Todas as informações reunidas são chamadas de Identificador Único de Medicamento (IUM), que será utilizada em cada unidade de medicamento dispensada.
Essa solução permitirá uma gestão mais eficaz dos riscos na cadeia dos produtos farmacêuticos e dar ao consumidor mais segurança, resolvendo sua preocupação com a segurança e autenticidade dos medicamentos.
Fonte:
- Anvisa
- ABCfarma
- Associação Brasileira de Automação (Rastreabilidade de medicamentos para a segurança do paciente) 25-02-19.
- Isabel Cristina Nogueira, (Gerenciando a Biblioteca do Amanhã: tecnologias para otimização e agilização dos serviços de informação).
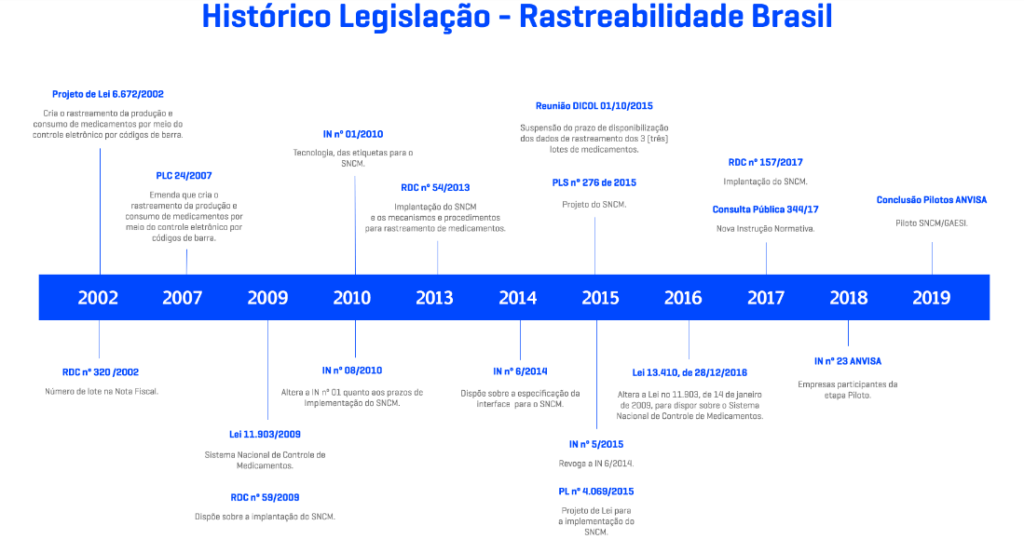
2002 – Projeto de Lei 6672/2002
2002 – RDC 320/2002
2007 – PLC 24/2007
2009 – Lei 11903/2009
2009 – RDC nº 59/2009
2010 – IN nº01/2010
2010 – IN nº08/2010
2013 – RDC nº 54/2013
2014 – N 6/2014
2015 – Reunião DICOL 01/10/2015
2015 – PLS n° 276 de 2015
2015 – IN 5/2015
2015 – PL nº 4069/2015
2016 – Lei nº 13.410, de 28/12/2016
2017 – RDC nº 157/2017
2017 – Consulta Pública 344/17
2018 – IN nº 23 ANVISA